Obsah
V tomto článku: Použití rychlých pravidel Vypočítejte rozpustnost odkazů Ksp9
Rozpustnost je termín používaný v chemii k popisu vlastností pevných sloučenin, které se zcela rozpustí v kapalinách, aniž by zanechaly nerozpuštěné částice. Rozpustné jsou pouze iontové sloučeniny (elektricky nabité). Chcete-li vyřešit praktické problémy, musíte si zapamatovat některé zásady nebo použít tabulku pravidel rozpustnosti. To vám pomůže vědět, zda se většina iontových sloučenin rozpustí, nebo ne, když jsou přidány do vody. Ve skutečnosti se některé molekuly rozpustí, i když si nevšimnete změny. Proto v případě experimentu vyžadujícího vyšší úroveň přesnosti bude možná nutné použít metodu výpočtu.
stupně
Část 1 Použijte rychlá pravidla
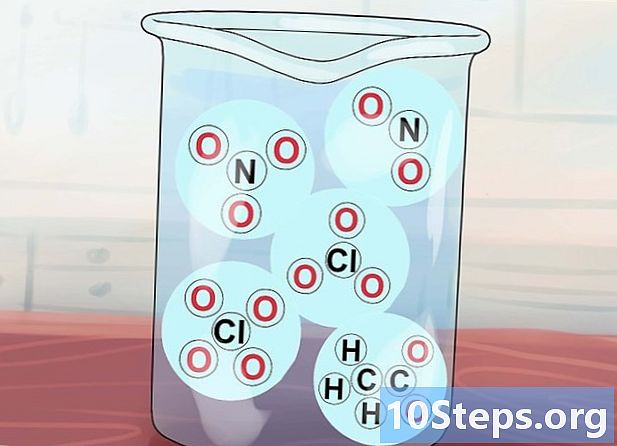
- Další informace o iontových sloučeninách. Každý atom obsahuje určité množství elektronů. Existují však případy, kdy atom přitahuje nebo ztratí jeden nebo více elektronů. Stává se tak ionto je elektricky nabitý chemický druh. Když se záporně nabitý ion (který má jeden nebo více dalších elektronů) spojuje s pozitivně nabitým iontem (který ztratil jeden nebo více elektronů), vytvoří se vazba stejným způsobem, jako jsou splněny opačné póly nabití magnetů. Tím se vytvoří iontová sloučenina.
- Ionty, které mají záporné náboje, se nazývají anion a ti, kteří jsou kladně obviněni, jsou kation.
- Obyčejné atomy obsahují stejný počet protonů a elektronů, což umožňuje neutralizovat elektrické náboje.
-
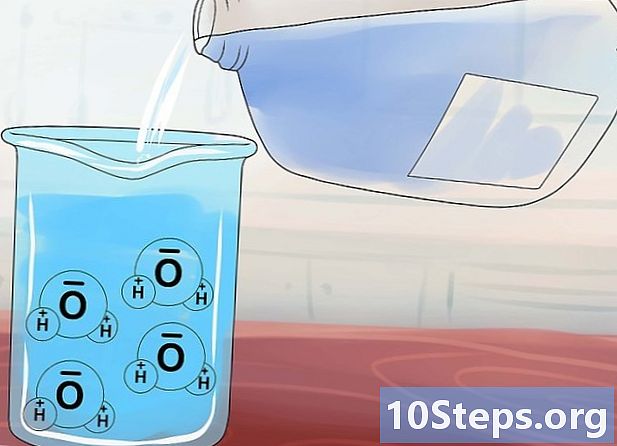
Pochopit pojem rozpustnosti. Molekuly vody (H2O) mají neobvyklou strukturu, díky které jsou podobné magnetu v tom, že mají kladný a záporný konec. Když přidáte iontovou sloučeninu do vody, tyto „tekuté magnety“ gravitují kolem sloučeniny a snaží se oddělit anionty od kationtů.- Iontové sloučeniny, jejichž chemická vazba není dostatečně silná, jsou rozpustnýprotože molekuly vody se mohou snadno oddělit a rozpustit. Naproti tomu sloučeniny se silnějšími vazbami jsou odolnější a jsou odolnější nerozpustnýprotože molekuly vody nejsou schopny je oddělit.
- Vnitřní vazby některých z těchto sloučenin mají podobnou sílu, jakou působí na ně voda. Tyto sloučeniny jsou považovány za mírně rozpustnýprotože významná část se rozpustí ve vodě a zbytek zůstává jednotný.
-

Naučte se pravidla rozpustnosti. Protože interakce mezi atomy jsou poměrně komplexní, není stanovení rozpustnosti sloučeniny vždy snadné. Sledujte první ion vaší sloučeniny, abyste viděli, jak normálně reaguje, poté zkontrolujte výjimky a ujistěte se, že nereaguje určitým způsobem.- Například vědět, zda chlorid strontnatý (SrCl2) je rozpustný nebo ne, pozorujte chování lva Sr nebo Cl. Cl je obecně rozpustný, potom zkontrolujte, zda je chlor výjimkou z pravidla. Sr není výjimkou, což znamená, že SrCl2 je rozpustná sloučenina.
- Hlavní výjimky z každého pravidla jsou popsány níže. Existují i další výjimky, ale setkáte se s nimi pouze během chemie nebo laboratorní zkušenosti.
-

Uvědomte si, že sloučenina je rozpustná, pokud obsahuje alkalický kov. Mezi ně patří: Li, Na, K, Rb a Cs. Tyto kovy jsou zahrnuty do seznamu prvků skupiny 1 (IA). Patří mezi ně lithium, sodík, draslík, rubidium a cesium. Téměř všechny iontové sloučeniny obsahující jeden z těchto prvků jsou rozpustné.- Výjimka: Li3PO4 je nerozpustný.
-

Znáte jiné rozpustné sloučeniny. Vím, že to není sloučenina3, C2H3O2, NE2, ClO3 nebo ClO4 je rozpustný. Jedná se o dusičnany, octany, dusitany, chlorečnany a chloristany. Nezapomeňte, že laketát je často zkrácen na OAC.- Výjimky: Ag (OAc) (octan stříbrný) a Hg (OAc)2 (octan rtuti) jsou nerozpustné.
- AgNO2 a KClO4 jsou mírně rozpustné.
-

Mějte na paměti, že sloučeniny Cl, Br a I jsou často rozpustné. Chloridové, bromidové a jodidové ionty tvoří téměř vždy rozpustné sloučeniny zvané halogenované soli.- Výjimka: kombinace jednoho z těchto iontů s ionty Ag (stříbro), Hg2 (rtuť) nebo Pb (olovo) vytváří nerozpustnou sloučeninu. To platí také pro méně obvyklé sloučeniny získané z iontů Cu (měď) a Tl (thallium).
-

Uvědomte si, že sloučeniny obsahující SO4 jsou obvykle rozpustné. Síran lva obvykle tvoří rozpustné sloučeniny, ale existuje několik výjimek.- Výjimky: síran lionu vytváří nerozpustné sloučeniny s následujícími ionty: Sr (stroncium), Ba (baryum), Pb (olovo), Ag (stříbro), Ca (vápník), Ra (radium) a Ag2 (diatomické stříbro). Nezapomeňte, že síran stříbrný a síran vápenatý se rozpustí jen natolik, aby byly považovány za slabě rozpustné sloučeniny.
-

Mějte na paměti, že sloučeniny obsahující OH nebo S jsou nerozpustné. Jedná se o hydroxid a sulfid.- Výjimky: pamatujete si alkalické kovy (prvky skupiny IA) a jak vytvářejí rozpustné sloučeniny? Li, Na, K, Rb a Cs jsou všechny ionty, které tvoří rozpustné sloučeniny s hydroxidem a sulfidem. Kromě toho hydroxid tvoří rozpustné soli s kovy alkalických zemin (chemické prvky 2. skupiny): Ca (vápník), Sr (stroncium) a Ba (baryum). Sloučeniny, které jsou výsledkem vazby mezi hydroxylem a kovy alkalických zemin, mají dostatek molekul, které zůstávají kompaktní a někdy jsou považovány za mírně rozpustné sloučeniny.
-

Uvědomte si, že sloučeniny obsahující CO3 nebo PO4 jsou nerozpustné. Jedná se o uhličitanový a fosfátový lev a měli byste vědět, co s těmito sloučeninami očekávat.- Výjimky: tyto ionty tvoří rozpustné sloučeniny s alkalickými kovy (Li, Na, K, Rb a Cs) a také amonný lion NH4.
Část 2 Vypočítejte rozpustnost Ksp
-

Hledejte konstantu rozpustnosti produktu Ksp. Jedná se o jinou konstantu pro každou sloučeninu, což znamená, že ji musíte hledat buď v tabulce nebo online. Protože je produkt rozpustnosti Ksp stanoven experimentálně, může se značně lišit v závislosti na používaném grafu, proto je nejlepší odkazovat na vaši chemickou knihu. Pokud není uvedeno jinak, většina tabulek ukazuje hodnoty Ksp pro několik pevných látek při 25 ° C.- Například pokud rozpustíte jodid olovnatý (PbI2), všimněte si jeho konstanty rozpustnosti. Pokud používáte tuto tabulku, musíte použít 7,1 × 10.
-

Napište chemickou rovnici. Nejprve určete, jak se váš chemický druh rozkládá na ionty, když se rozpustí, a potom napište rovnici získáním konstanty K na jedné straněsp a ionty složek na druhé straně.- Například molekuly PbI2 Rozkládají se na ionty Pb, I a I. Protože elektronický náboj sloučeniny je neutrální, stačí znát náboj jednoho z iontů pro výpočet náboje druhého.
- Rovnici napište následujícím způsobem: 7.1 × 10 =.
- Rovnice se týká konstanty rozpustnosti chemického těla. Najdete ji v tabulce produktů rozpustnosti. Protože existují 2 ionty, musíte zvýšit tento prvek na druhou.
-

Znovu přeformulujte rovnici, abyste mohli použít proměnné. Přepište rovnici, jako by to byl jednoduchý algebraický problém s využitím počtu zapojených molekul a dionů. Předpokládejme, že x se rovná množství sloučeniny, která se rozpustí a přeskupí proměnné, které představují množství každého iontu tak, že závisí na x.- V našem příkladu ji musíme přepsat jako 7,1 × 10 =.
- Protože ve sloučenině je olovnatý iont (Pb), musí být počet rozpuštěných molekul roven počtu volných olovnatých iontů. Proto = x.
- Protože pro každý olověný iont existují dva iontové diody (I), můžeme říci, že počet datových diod se rovná 2x.
- Rovnice se stane: 7,1 × 10 = (x) (2x).
-

Zvažte běžné atomy, pokud existují. Pokud se pokusíte rozpustit sloučeninu v čisté vodě, tento krok ignorujte. Pokud je však sloučenina rozpuštěna v roztoku obsahujícím jeden nebo více iontů, které jsou součástí ("běžné ionty"), je rozpustnost solutu významně snížena. Tento účinek je zvláště důležitý u sloučenin, které jsou do značné míry nerozpustné, a v těchto případech můžete předpokládat, že převážná většina iontů v rovnováze pochází z iontů přítomných v roztoku. Přepište rovnici tak, aby zahrnovala neznámou molární koncentraci (mol / l nebo M) iontů přítomných v roztoku. Za tímto účelem nahraďte hodnotu x použitou pro tento ion.- Například, pokud byla sloučenina jodidu olovnatého rozpuštěna v roztoku s 0,2 M chloridem olovnatým (PbCl2) by rovnice vypadala takto: 7,1 × 10 = (0,2 M + x) (2x). Poté, protože koncentrace 0,2 M je podstatně větší než hodnota x, lze rovnici dále přepsat takto: 7,1 x 10 = (0,2 M) (2x).
-

Zkuste vyřešit rovnici. Najděte hodnotu x pro výpočet rozpustnosti sloučeniny. Odpověď, kterou dostanete, bude vyjádřena v molech rozpuštěných sloučenin na litr vody. Je to kvůli tomu, jak je definována konstanta rozpustnosti. Proto můžete potřebovat kalkulačku k nalezení konečného výsledku.- Následující rovnice platí pro rozpustnost sloučeniny v čisté vodě a ne v roztoku obsahujícím běžné ionty.
- 7,1 × 10 = (x) (2x).
- 7,1 × 10 = (x) (4x).
- 7,1 × 10 = 4x.
- (7,1 × 10) 4 = x.
- x = ∛ ((7,1 × 10) ÷ 4).
- x = 1,2 x 10 mol na litr, To je množství krtků, které se rozpustí. Protože se jedná o velmi malé množství, lze říci, že sloučenina je nerozpustná.

- Tabulka seskupující hodnoty (Ksp) pro různé pevné látky
- Pokud máte experimentální údaje o množství rozpuštěné sloučeniny, můžete použít stejnou rovnici k nalezení konstanty rozpustnosti Ksp .
- Neexistuje všeobecně přijímaná definice těchto termínů, ale chemici obětují většinu sloučenin. Některé sloučeniny, které mají významné množství rozpuštěných a nerozpuštěných molekul, mohou být v tabulkách rozpustnosti popsány odlišně.
- Některé staré knihy považují amoniak (NH4OH) jako rozpustná sloučenina, což je chyba. Malá množství NH dionů4 a OH mohou být detekovány, ale nemohou být izolovány za vzniku sloučeniny.